Contente
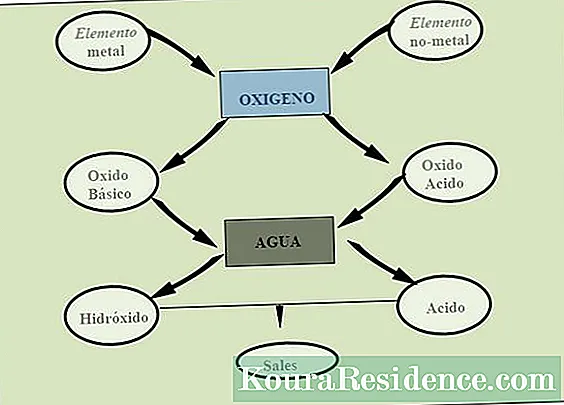
ohidróxidos resultado da combinação de um óxido metálico (também chamados de óxidos básicos) e água. Desta forma, a composição dos hidróxidos é dada por três elementos: oxigênio, hidrogênio e o metal em questão. Em combinação, o metal sempre atua como cátion e o elemento do grupo hidróxido atua como um ânion.
Os hidróxidos em geral compartilham uma série de características, como ter um sabor amargo como sabão, ser escorregadios ao toque, ser corrosivos, ter algumas propriedades detergentes e saponáceos, dissolvendo óleos e enxofre e reagindo com ácidos a produzir sais.
Algumas características, por outro lado, são específicas de cada tipo de hidróxido, como o sódio, que absorve rapidamente dióxido de carbono e água; o do cálcio obtido na reação do óxido de cálcio com a água; ou ferro (II) que é praticamente insolúvel em água.
Para que são usados?
As aplicações de hidróxidos também variam entre os diferentes casos:
- o de hidróxido de sódio, por exemplo, está associada à indústria de sabonetes e produtos de beleza e cuidados com o corpo.
- o hidróxido de cálcioPor outro lado, tem papel intermediário em alguns processos como o de obtenção de carbonato de sódio.
- o hidróxido de lítio É utilizado na fabricação de cerâmicas, enquanto o magnésio é utilizado como antiácido ou laxante.
- o hidróxido de ferro Eles são usados no processo de fertilização de plantas.
Nomenclaturas
Quanto a muitas das combinações químicas, existem diferentes nomenclaturas para hidróxidos:
- o nomenclatura tradicional, por exemplo, é aquele que começa com a palavra hidróxido seguindo o elemento, mas levando em conta a valência com que atua: quando for com uma valência será usada a desinência 'ico', quando estiverem com dois será aquele com a desinência de maior valência 'urso' e aquele com final menor em 'ico', e quando operar com três ou quatro valências, o início 'soluço' ou 'per' também será adicionado dependendo do caso.
- o Nomenclatura de ações é aquele que usa a palavra hidróxido, mas ao invés de complementar com uma única palavra, usa a preposição 'de' e depois o metal, colocando as valências entre parênteses.
- o nomenclatura sistemática é aquele que prefixa os prefixos numéricos da palavra hidróxido.
Exemplos de hidróxidos
- Hidróxido de chumbo (II), Pb (OH)2, dihidróxido de chumbo.
- Hidróxido de platina (IV), Pt (OH)4, quadhidróxido de platina.
- Hidróxido vanádico, V (OH)4, tetra-hidróxido de vanádio.
- Hidróxido ferroso, Fe (OH)2, dihidróxido de ferro.
- Hidróxido de chumbo (IV), Pb (OH) 4, tetra-hidróxido de chumbo.
- Hidróxido de prata, AgOH, hidróxido de prata.
- Hidróxido de cobalto, Co (OH)2, dihidróxido de cobalto.
- Hidróxido de manganês, Mn (OH)3, trihidróxido de manganês.
- Hidróxido férrico, Fe (OH)3, trihidróxido de ferro.
- Hidróxido cúprico, Cu (OH)2, dihidróxido de cobre.
- Hidróxido de alumínio, Al (OH)3, trihidróxido de alumínio.
- Hidróxido de sódio, NaOH, hidróxido de sódio.
- Hidróxido de estrôncio, Sr (OH)2, dihidróxido de estrôncio.
- Hidróxido de magnésio, Mg (OH)2, dihidróxido de magnésio.
- Hidróxido de amônio, NH4OH, hidróxido de amônio.
- Hidróxido de cádmio, Cd (OH)2, dihidróxido de cádmio.
- Hidróxido vanádico, V (OH)3, trihidróxido de vanádio.
- Hidróxido de mercúrio, Hg (OH)2, dihidróxido de mercúrio.
- Hidróxido cuproso, CuOH, hidróxido de cobre.
- Hidróxido de lítio, LiOH, hidróxido de lítio.
Às vezes, os hidróxidos têm nomes comuns dados por seus usos mais convencionais, como hidróxido de sódio, também chamado de soda cáustica, hidróxido de potássio, que é chamado de potassa cáustica, hidróxido de cálcio, que é chamado de água de cal ou cal temperado, e o do magnésio chamado leite de magnésia.
- Siga com: Exemplos de hidróxidos (explicado)


